Co je hydrogenuhličitan amonný?
Zjistěte, co je hydrogenuhličitan amonný z fyzikálních a chemických vlastností
Hydrogenuhličitan amonný je bílá sloučenina, která se při pokojové teplotě jeví jako bílé krystaly a má stopové množství amoniakového zápachu. Při konzervaci je třeba dbát na to, protože hydrogenuhličitan amonný je uhličitan, který reaguje s kyselinou za vzniku oxidu uhličitého. Tím se hydrogenuhličitan amonný znehodnocuje, takže jej nelze s kyselinou smířit.
Za normálních okolností by měl být hydrogenuhličitan amonný skladován v chladu a suchu. Během skladování a přepravy je třeba dbát na vlhkost, déšť a sluneční záření. Neměl by být smíchán s oxidačními činidly, kyselinami ani chemikáliemi.
Hydrogenuhličitan amonný lze použít jako hnojivo pro plodiny
Na venkově se k reakci často využívají vlastnosti hydrogenuhličitanu amonného a kyseliny. V uzavřeném prostoru se hydrogenuhličitan amonný umístí na vyvýšené místo a přidá se zředěná kyselina chlorovodíková. Po reakci se může vytvořit dostatek oxidu uhličitého pro fotosyntézu rostlin, čímž se zvýší výnos zeleniny. Chlorid amonný vzniklý reakcí lze také znovu použít jako hnojivo.
Hydrogenuhličitan amonný lze samozřejmě použít i jako dusíkaté hnojivo. Může poskytnout amonný dusík a oxid uhličitý potřebné pro růst rostlin. Po aplikaci do půdy mohou amonné ionty a oxid uhličitý obsažené v hydrogenuhličitanu amonném přímo absorbovat rostliny. Způsobí to určité zbytkové množství půdy a má malý vliv na její kvalitu.
Hydrogenuhličitan amonný jako hasicí prostředek
Hydrogenuhličitan amonný je také často považován za vynikající materiál pro výrobu hasicích přístrojů. Hydrogenuhličitan amonný a síran hlinitý lze použít jako hasicí materiál pro oxid uhličitý, oxid hlinitý a síran sodný, protože uhličitan v hydrogenuhličitanu amonném je slabý kyselý anion, hliník. Jedná se o slabý zásaditý kationt a tyto dva ionty vzájemně podporují dvojitou hydrolýzu za vzniku pěny, která může účinně uhasit požár.
Hydrogenuhličitan amonný jako kypřicí látka v potravinách
Hydrogenuhličitan amonný byl poprvé použit jako kypřicí prostředek. Vyráběl se z rohů sobů na zemi. Byl také jedním z prvních prášků do pečiva. Před vznikem jedlé sody a dalších prášků do pečiva Evropané často vyráběli hydrogenuhličitan amonný. Chléb a sušenky, ve kterých se hydrogenuhličitan amonný používá jako kypřicí prostředek v potravinách, se rozkládá a uvolňuje amoniak a oxid uhličitý. Nadýchaný plyn reaguje s nadýchanou kyselinou, čímž se jídlo stává nadýchanějším a pružnějším, protože sušenky vyrobené z hydrogenuhličitanu amonného neobsahují žádné zbytky amoniaku a mohou také zajistit maximální křupavost sušenek, takže si někteří Evropané tento zvyk zachovali.
Před příchodem moderního čínského prášku do pečiva se často používal k výrobě mandlových sušenek a dušených bulek. Přestože se během pečení projevovala trpkost a čpavkový zápach, rychle zmizel bez zanechání jakékoli chuti.
Jiný název pro hydrogenuhličitan amonný: startér
Kromě kypřicího prostředku má hydrogenuhličitan amonný i jiný název, a to startér. Podle seznamu speciálních potravinářských složek EU existuje 10 druhů startérů, včetně E341 fosforečnanu vápenatého, E343 fosforečnanu hořečnatého, E450 difosforečnanů, E500 uhličitanu sodného, E 500 I uhličitanu sodného, E 500 II – hydrogenuhličitanu sodného, E 500 III – seskviuhličitanu sodného, E 541 – fosforečnanu hlinito-sodného, E 574 – kyseliny glukonové, E 575 – glukono-delta-laktonu.
Ovlivňují potravinu prostřednictvím její schopnosti tvořit během pečení oxid uhličitý, z nichž většina slouží k provzdušnění těsta, čímž zvyšují elasticitu a viskozitu těsta pro dosažení optimálního objemu výrobku.
Metoda syntézy hydrogenuhličitanu amonného
Jak je znázorněno na obrázku níže, stlačený oxid uhličitý se vede do koncentrované amoniakové vody, aby se udržel tlakový stav oxidu uhličitého, a roztok se ochladí, krystaly se vysrážejí, oddělí se centrifugací a dehydratují se za vzniku krystalů hydrogenuhličitanu amonného.
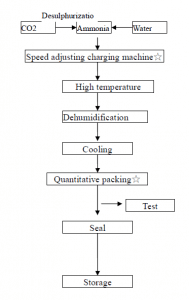
Některé typické malé závody na výrobu dusíkatých hnojiv v Číně používají antracit jako surovinu k přípravě polovodného plynu. Ten po odstranění sirovodíku vstupuje do karbonizační věže a směs dusíku, vodíku a oxidu uhličitého získaná v systému tlakové konverze vstupuje do karbonizační věže. Asi 17% amoniakové vody reaguje za vzniku krystalů hydrogenuhličitanu amonného, které se oddělují odstředivkou za účelem získání hydrogenuhličitanu amonného.
Bezpečnostní opatření při používání hydrogenuhličitanu amonného
Pokud se náhodou dotknete kůže s určitou koncentrací hydrogenuhličitanu amonného, nejprve odstraňte kontaminovaný oděv a opláchněte tekoucí vodou. Při náhodném zasažení očí je vypláchněte fyziologickým roztokem určité koncentrace. V případě potřeby okamžitě vyhledejte lékařskou pomoc. Pokud se vám do úst náhodně vdechne, opusťte postižené místo na čerstvý vzduch. Pokud máte potíže s dýcháním, okamžitě vyhledejte lékařskou pomoc po podání kyslíku. Pokud se náhodou najíte, vypijte dostatek vody a po zvracení ihned vyhledejte lékařskou pomoc.
Synonyma: hydrogenuhličitan amonný; kyselina uhličitá, monoamoniová sůl; monoamoniumkarbonát; kyselý uhličitan amonný; hydrogenuhličitan amonný; paroh; AmBic;













