Що таке бікарбонат амонію?
Дізнайтеся, що таке бікарбонат амонію за його фізичними та хімічними властивостями
Бікарбонат амонію — це біла сполука, яка за кімнатної температури виглядає білою, у вигляді зернистих кристалів, зі слідами аміачного запаху. Це слід враховувати під час зберігання, оскільки бікарбонат амонію — це карбонат, який реагує з кислотою, утворюючи вуглекислий газ. Таким чином, гідрокарбонат амонію псується, тому його не можна розміщувати разом з кислотою.
За нормальних обставин, зберігання бікарбонату амонію слід проводити в прохолодному та сухому місці. Під час зберігання та транспортування слід звертати увагу на вологість, дощ та сонячне світло. Його не слід змішувати з окислювачами, кислотами чи хімікатами.
Бікарбонат амонію можна використовувати як добриво для сільськогосподарських культур
У сільській місцевості для реакції часто використовуються характеристики бікарбонату амонію та кислоти. У герметичному просторі бікарбонат амонію розміщують на високій ділянці та додають розведену хлоридну кислоту. Після реакції може утворитися достатня кількість вуглекислого газу для фотосинтезу рослин, тим самим збільшуючи врожайність овочів. Хлорид амонію, що утворюється в результаті реакції, також можна повторно використовувати як добриво.
Звичайно, бікарбонат амонію також можна використовувати як азотне добриво. Він може забезпечити амонійний азот та вуглекислий газ, необхідні для росту рослин. Після внесення в ґрунт іони амонію та вуглекислий газ, що містяться в бікарбонаті амонію, можуть безпосередньо поглинатися рослинами. Це призведе до утворення певного залишкового ґрунту та мало вплине на його якість.
Бікарбонат амонію як вогнегасник
Бікарбонат амонію також часто вважається чудовим матеріалом для виготовлення вогнегасників. Бікарбонат амонію та сульфат алюмінію можна використовувати як вогнегасний матеріал для вуглекислого газу, глинозему та сульфату натрію, оскільки карбонат у бікарбонаті амонію є слабким кислотним аніоном алюмінію. Він є слабким основним катіоном, і два іони взаємно сприяють подвійному гідролізу з утворенням піни, яка може ефективно загасити вогонь.
Бікарбонат амонію як розпушувач у харчових продуктах
Бікарбонат амонію вперше використовували як розпушувач. Його виготовляли з рогів північного оленя на землі. Він також був одним із найдавніших розпушувачів. До появи харчової соди та інших розпушувачів європейці часто виготовляли бікарбонат амонію. Хліб та печиво, в яких бікарбонат амонію використовувався як розпушувач у харчових продуктах, під час чого бікарбонат амонію розкладається та вивільняє аміак і вуглекислий газ. Пухнастий газ реагує з пухнастою кислотою, роблячи їжу більш пухкою та еластичною, оскільки печиво, виготовлене з бікарбонату амонію, не містить залишків амонію, а також може забезпечити найбільшу хрусткість печива, тому деякі європейці зберегли таку звичку.
До появи сучасного китайського розпушувача його часто використовували для приготування мигдалевого печива та парових булочок. Хоча під час випікання відчувалася терпкість і запах аміаку, вона швидко зникала, не залишаючи жодного смаку.
Інша назва бікарбонату амонію: закваска
Окрім розпушувача, бікарбонат амонію має ще одну назву – закваска. Відповідно до спеціальних харчових інгредієнтів ЄС, існує 10 видів заквасок, включаючи E341 фосфат кальцію, E343 фосфат магнію, E450 ДИФОСФАТИ, E500 карбонат натрію, E 500 I карбонат натрію, E 500 II – бікарбонат натрію, E 500 III – сесквікарбонат натрію, E 541 – фосфат натрію алюмінію, кислий, E 574 – глюконова кислота, E 575 – глюконо-дельта-лактон.
Вони впливають на їжу через її здатність утворювати вуглекислий газ під час процесу випікання, більшість з яких діє для вентиляції тіста під час випікання, збільшуючи еластичність та в'язкість тіста для досягнення оптимального об'єму продукту.
Спосіб синтезу гідрокарбонату амонію
Як показано на малюнку нижче, стиснений вуглекислий газ пропускають у концентровану аміачну воду для підтримки стисненого стану вуглекислого газу, розчин охолоджують, кристали осаджуються, відокремлюються центрифугуванням та зневоднюються з утворенням кристалів гідрокарбонату амонію.
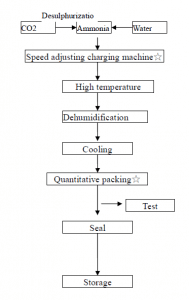
Деякі типові невеликі заводи з виробництва азотних добрив у Китаї використовують антрацит як сировину для отримання напівводяного газу. Останній потрапляє до карбонізаційної вежі після видалення сірководню, а суміш азоту, водню та вуглекислого газу, отримана в системі реакції перетворення тиску, потрапляє до карбонізаційної вежі. Близько 17% аміачної води реагує з утворенням кристалів бікарбонату амонію, які відділяються центрифугою для отримання продукту бікарбонату амонію.
Застереження при використанні бікарбонату амонію
Якщо ви випадково доторкнулися до шкіри з певною концентрацією бікарбонату амонію, спочатку зніміть забруднений одяг, промийте проточною водою, при випадковому потраплянні в очі промийте їх розчином фізіологічного розчину певної концентрації, за необхідності негайно зверніться за медичною допомогою. Якщо ви випадково вдихнули через рот, слід залишити це місце на свіжому повітрі. Якщо у вас виникли труднощі з диханням, слід негайно звернутися за медичною допомогою після вживання кисню. Якщо ви випадково поїли, необхідно випити достатню кількість води, а потім, після блювоти, негайно звернутися за медичною допомогою.
Синоніми: бікарбонат амонію; вугільна кислота, моноамонієва сіль; моноамонійкарбонат; кислотний карбонат амонію; гідрогенкарбонат амонію; оленячі роги; AmBic;













