Какво е амониев бикарбонат?
Разберете какво е амониев бикарбонат от физични и химични свойства
Амониевият бикарбонат е бяло съединение, което при стайна температура изглежда като бели гранулирани кристали и има следи от амонячна миризма. Това трябва да се отбележи при съхранение, тъй като амониевият бикарбонат е карбонат, който реагира с киселината, за да образува въглероден диоксид. По този начин амониевият хидрогенкарбонат се разгражда и не може да се смесва с киселината.
При нормални обстоятелства, съхранението на амониевия бикарбонат трябва да се извършва на хладно и сухо място. По време на съхранение и транспортиране трябва да се обърне внимание на влага, дъжд и излагане на слънце. Не трябва да се смесва с окислители, киселини или химикали.
Амониевият бикарбонат може да се използва като тор за култури
В провинцията характеристиките на амониевия бикарбонат и киселината често се използват за реакция. В запечатано пространство амониевият бикарбонат се поставя на високо място и се добавя разредена солна киселина. След реакцията може да се генерира достатъчно въглероден диоксид за фотосинтеза на растенията, като по този начин се увеличава добивът на зеленчуци. Амониевият хлорид, образуван от реакцията, може да се използва повторно като тор.
Разбира се, амониевият бикарбонат може да се използва и като азотен тор. Той може да осигури амониев азот и въглероден диоксид, необходими за растежа на растенията. След прилагане върху почвата, амониевите йони и въглеродният диоксид, съдържащи се в амониевия бикарбонат, могат да бъдат директно абсорбирани от растенията. Това ще доведе до образуване на остатъци в почвата и ще има малък ефект върху нейното качество.
Амониев бикарбонат като пожарогасител
Амониевият бикарбонат също често се счита за отличен материал за направата на пожарогасители. Амониевият бикарбонат и алуминиевият сулфат могат да се използват като пожарогасителен материал за въглероден диоксид, алуминиев оксид и натриев сулфат, тъй като карбонатът в амониевия бикарбонат е слаб киселинен анион, алуминий. Той е слаб основен катион и двата йона взаимно подпомагат двойната хидролиза, за да образуват пяна, която може ефективно да потуши пожара.
Амониев бикарбонат като набухвател в храните
Амониевият бикарбонат е използван за първи път като набухвател. Той е бил направен от рогата на северните елени, отглеждани на земята. Той е бил и един от най-ранните бакпулвери. Преди появата на содата бикарбонат и други бакпулвери, европейците често са правили амониев бикарбонат. Хляб и бисквити, в които амониевият бикарбонат се използва като набухвател в храните, по време на което амониевият бикарбонат се разлага и освобождава амоняк и въглероден диоксид. Пухкавият газ реагира с пухкавата киселина, за да направи храната по-пухкава и еластична, тъй като бисквитите, направени от амониев бикарбонат, нямат амониеви остатъци и могат да осигурят максимална хрупкавост на бисквитите, така че някои европейци са запазили този навик.
Преди появата на съвременния китайски бакпулвер, той често се е използвал за приготвяне на бадемови бисквити и кифлички на пара. Въпреки че по време на печене се е усещала стипчивост и миризма на амоняк, тя бързо е изчезвала, без да оставя никакъв вкус.
Друго наименование за амониев бикарбонат: стартер
В допълнение към набухватела, амониевият бикарбонат има и друго наименование, а именно закваска. Според специализираните хранителни съставки на ЕС, има 10 вида закваски, включително E341 калциев фосфат, E343 магнезиев фосфат, E450 ДИФОСФАТИ, E500 натриев карбонат, E 500 I натриев карбонат, E 500 II – натриев бикарбонат, E 500 III – натриев сесквикарбонат, E 541 – натриев алуминиев фосфат, киселинен, E 574 – глюконова киселина, E 575 – глюконо-делта-лактон.
Те влияят на храната чрез способността ѝ да образува въглероден диоксид по време на процеса на печене, като повечето от тях действат за вентилиране на тестото по време на печенето, увеличавайки еластичността и вискозитета на тестото, за да се постигне оптимален обем на продукта.
Метод за синтезиране на амониев хидрогенкарбонат
Както е показано на фигурата по-долу, компресираният въглероден диоксид се прекарва в концентрирана амонячна вода, за да се поддържа налягането на въглеродния диоксид, и разтворът се охлажда, кристалите се утаяват, отделят се чрез центрофугиране и се дехидратират, за да се образуват кристали амониев хидрогенкарбонат.
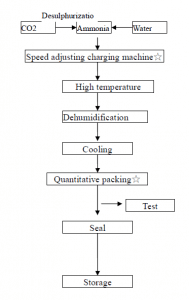
Някои типични малки заводи за азотни торове в Китай използват антрацит като суровина за получаване на полуводен газ. Последният постъпва в карбонизационната кула след отстраняване на сероводорода, а сместа от азот, водород и въглероден диоксид, получена в системата за реакция на преобразуване под налягане, постъпва в карбонизационната кула. Около 17% амонячна вода реагира, за да образува кристали амониев бикарбонат, които се отделят чрез центрофуга, за да се получи амониев бикарбонат.
Предпазни мерки при употреба на амониев бикарбонат
Ако случайно докоснете кожата с определена концентрация на амониев бикарбонат, първо свалете замърсените дрехи, изплакнете с течаща вода. При случаен контакт с очите, изплакнете с определена концентрация на физиологичен разтвор. Ако е необходимо, незабавно потърсете медицинска помощ. Ако случайно вдишате през устата, трябва да напуснете мястото на чист въздух. Ако имате затруднено дишане, незабавно потърсете медицинска помощ след кислород. Ако случайно ядете, трябва да изпиете достатъчно вода и след повръщане незабавно потърсете медицинска помощ.
Синоними: амониев бикарбонат; въглеродна киселина, моноамониева сол; моноамониев карбонат; киселинен амониев карбонат; амониев хидрогенкарбонат; еленов рог; AmBic;













